ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА
Прозорливый ум
Нильса Бора (1885—1962) "увидел" однажды, что атом подобен Солнечной системе: в центре положительное ядро, а вокруг него маленькие "планеты" - отрицательные электроны. Такую модель атома так и стали называть — планетарной (
подробнее здесь,
видео тут). Как всегда, всё оказалось совсем
не так просто, споры о ней не утихают до сих пор.
Компьютерными средствами легко смоделировать устройство такого атома, как водород. Один протон, вокруг которого вращается один электрон. Это моделирование интересно тем, что поможет нам увидеть, как простые и понятные правила и законы могут иметь необычные проявления в природе, и как эти законы и правила помогут нам просто и наглядно объяснить вещи, поначалу ставившие больших учёных в тупик. Формул и вычислений нам конечно не избежать, но отдадим это "умному" компьютеру, а себе оставим самое "вкусное" — смотреть и делать выводы.
Задание. Понять, как можно объяснить линейчатый спектр излучения атома, как можно снять противоречия планетарной модели атома:
- невозможность падения электрона на ядро;
- наличие стационарных орбит;
- отсутствие излучения при движении электрона по стационарным орбитам.
Важно! Надо понимать, что не всё возможно в нашем мире.
- Природа не терпит пустоты, невозможно представить себе длину предмета без самого предмета. Длина ничего равна ничему. Пространство не может быть разорвано.
Природа скупа и всегда действует по пути связанному с наименьшими затратами (
наименьшим действием). Возьмём пример: река, текущая по извилистому руслу. Странно было бы видеть воду реки перепрыгивающую через гору вместо того, чтобы обогнуть её. В физике мы чаще всего имеем дело с полями, образующими потенциалы в рассматриваемой точке пространства.
Принцип наименьшего действия, упомянутый выше, органично приводит к требованию
непрерывности и гладкости функций, описывающих наблюдаемый мир. Разорванное поле? Приода на такое не пойдёт!
- Силовые линии вихревого электрического и магнитного поля должны быть непрерывны, замкнуты сами на себя и не иметь изломов. Другими словами, не всякое ЭМ поле возможно.
- Все действия (E·t, где Е - энергия, t - время излучения) в природе дискретны, они могут быть только кратны целому h - постоянной М.Планка (иначе будет нарушены предыдущие два пункта). h =6.62607015·10
-34 Дж·с = 4.136·10
-15 эВ·с.
Польза от изучения электрического разряда в газе. Удивительным образом характер спектра излучения газов (
подробнее здесь) оказался связан со строением электронных оболочек их атомов. Изучая эти спектры можно вычислить энергии электронов на орбитах, а следовательно и радиусы орбит, и период обращения, и скорость электронов и много что ещё, чтобы понять устройство атома. Значения этих величин для электрона в атоме вы сможете видеть в таблице над анимацией. Их для вас любезно будет вычислять компьютер, чтобы не занимать ваше время. Ведь иногда цифры бывают не менее важны, чем формулы и уравнения для понимания происходящего.
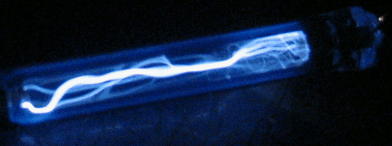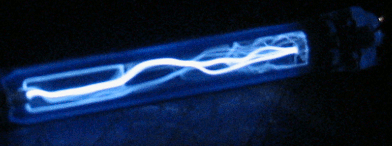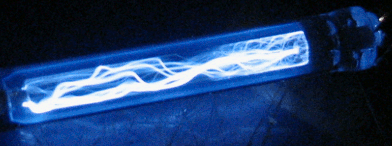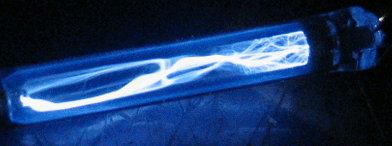
В нашем виртуальном опыте мы будем, подавая напряжение на газоразрядную трубку (
подробнее здесь), бомбардировать атом водорода электронами, имеющими определенную нами энергию, и смотреть, как поведёт себя электрон атома водорода под этим воздействием. Фото установки вы видите справа, а ещё правее более крупным планом — газоразрядную трубку в темноте. Можно нажать кнопку ВКЛ, чтобы подать на трубку напряжение, и увидеть газовый разряд. Не забудьте после наблюдения выключить питание кнопкой ВЫКЛ, чтобы не грузить процессор вашего компьютера, он ещё вам пригодится.
Описание установки. На анимации (см. ниже справа) условно изображён атом водорода: в центре протон, а вокруг него на одной из стационарных орбит вращается электрон.
Нажав кнопку РАЗРЯД, можно пропустить через газоразрядную трубку импульс тока высокого напряжения. Энергию удара от 0 до 16 эВ мы можем заранее задать движками, значение этой энергии ΔE высветится рядом. Верхний движок задает грубо энергию удара, нижний — более точно. Как только вы зададите энергию, необходимую для перехода электрона на более высокую орбиту, он перейдёт на неё и останется там на некоторое время, а затем перейдет на более низкую орбиту, излучив при этом на короткое время квант света определённой длины волны (цвета). Во второй сверху ячейке таблицы появится значение энергии испущенного кванта света E
кв, а ниже длина его волны λ
кв. Кванты видимого света будут отображены на короткое время линией соответствующего цвета внизу таблицы (как в спектроскопе).
Замечание. Виртуальный эксперимент является имитацией и служит для целей обучения исследовательской деятельности.
Дробные числа вводите в ответы через точку. Ответы следует округлять по правилам округления с точностью не более 10%.
Счастливых открытий!