 Атом, считавшийся по древнегреческим представлениям неделимым, имеет на самом деле сложное строение.
Атом, считавшийся по древнегреческим представлениям неделимым, имеет на самом деле сложное строение. Резерфорд: атом состоит из ядра и электронов, обращающихся вокруг ядра.
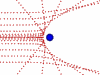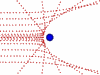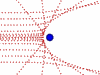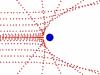
Опыт Резерфорда: поток α-частиц (движущиеся красные точки на рисунке) сталкивался с атомами золота.
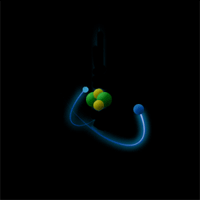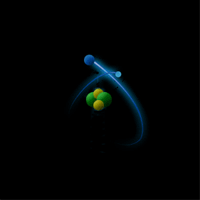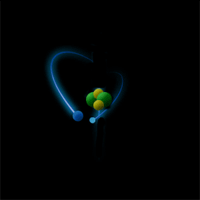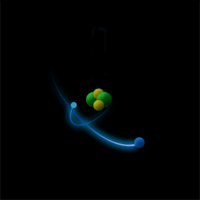 Большинство частиц мало отклонялось от первоначальной траектории (значит атомы почти "пустые" внутри), и лишь некоторые из них отклонялись всторону (в центре атома маленькое, положительно заряженное ядро /синий кружок/).
Большинство частиц мало отклонялось от первоначальной траектории (значит атомы почти "пустые" внутри), и лишь некоторые из них отклонялись всторону (в центре атома маленькое, положительно заряженное ядро /синий кружок/).Ядро состоит из протонов и нейтронов, которых в ядре данного атома (изотопа) вполне закономерное количество:
(Насколько малы атомы.mp4)
 - состав ядра атома можно определить по таблице Менделеева.
- состав ядра атома можно определить по таблице Менделеева.
Ядра изотопов одного элемента отличаются друг от друга только количеством нейтронов в их ядрах.
Количество электронов в нейтральном атоме равно количеству протонов Z.
У ионов число электронов не равно Z.
Параметры атомного ядра обычно записывают с помощью индексов, например: 42He.
Верхний индекс представляет собой округленное значение массового числа элемента (частицы) в а.е.м., то есть для данного примера АНе = 4.
Нижний индекс является порядковым номером элемента в табл. Менделеева (заряд ядра /частицы/), то есть для данного примера ZНе = 2 (заряд ядра Не равен по модулю двум зарядам электрона).
Понятно, что число нейтронов в составе данного ядра (см. формулу выше) ZНе = 4 – 2 = 2.
Электроны вокруг ядра согласно Бору обращаются по вполне закономерным орбитам.
Движение заряженных тел всегда сопровождается излучением электромагнитных волн, но движение электрона по боровской орбите не сопровождается излучением.
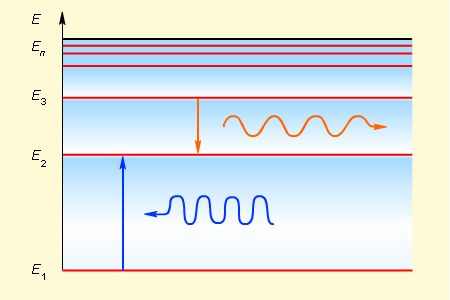 Переход электрона с верхней орбиты на нижнюю напротив сопровождается излучением кванта электромагнитной энергии (переход Е3 —> Е2 с излучением кванта оранжевого света):
Переход электрона с верхней орбиты на нижнюю напротив сопровождается излучением кванта электромагнитной энергии (переход Е3 —> Е2 с излучением кванта оранжевого света):Переход электрона с нижней орбиты на верхнюю требует поглощения кванта электромагнитной энергии (перех