Изотермический процесс (T = const, следовательно ΔU = 0).
По первому закону термодинамики: Q = A'.
Газ совершает работу A' за счет подводимого тепла Q (A'>0, Q>0).
Совершение работы внешними силами A (сжатие газа) требует отвода тепла Q от газа для сохранения его температуры (A>0, Q<0).
Изохорный процесс (V = const, следовательно A = 0).
По первому закону термодинамики: ΔU = Q.
Нагревание газа в закрытом сосуде приводит к увеличению его внутренней энергии U (температуры) (Q>0, ΔU>0).
Охлаждение газа в закрытом сосуде приводит к уменьшению его внутренней энергии U (температуры) (Q<0, ΔU<0).
Изобарный процесс (p = const).
По первому закону термодинамики: Q = ΔU + A'.
Подводимое к газу тепло Q частично идет на увеличение внутренней энергии U, а частично на совершение работы газом A' (Q>0, ΔU>0, A'>0).
Работа внешних сил A при изобарном сжатии газа требует отвода тепла Q от газа, одновременно уменьшается его внутренняя энергия U (Q<0, ΔU<0, A>0).
Адиабатный процесс - процесс, протекающий без теплообмена с окружающей средой (Q = 0).
По первому закону термодинамики: ΔU = A.
Вся работа внешних сил А идет только на увеличение внутренней энергии газа (A>0, ΔU>0).
Работа газа А' совершается только за счет потери внутренней энергии газа (A'>0, ΔU<0).
Полезные формулы:
 Изменение внутренней энергии
Изменение внутренней энергии идеального одноатомного газа.
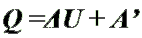 Количество теплоты, переданное телу,
Количество теплоты, переданное телу, идет на изменение его внутренней энергии
и на совершение им работы (Первый закон термодинамики).
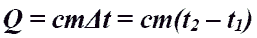 Количество теплоты при нагревании и охлаждении газа.
Количество теплоты при нагревании и охлаждении газа.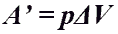 Работа газа при изобарном процессе (p = const)
Работа газа при изобарном процессе (p = const)(to + 273)